科技博览
细胞死亡是生命过程中持续发生且不可逆转的一种现象,这有助于机体正常功能的行使和功能的维持。在多种细胞死亡方式中,程序性坏死会被肿瘤坏死因子(tumour necrosis factor,TNF)等死亡相关受体配体(death receptor ligands)激活。感应到 TNF 后,肿瘤坏死因子受体1(TNFR1)会激活受体相互作用蛋白激酶1(RIPK1),RIPK1 会与受体相互作用蛋白激酶3(RIPK3)形成被称为坏死体(necrosome)的蛋白复合物。一旦这条通路被激活,RIPK3 会将其下游效应因子——混合谱系激酶结构域样蛋白(MLKL),磷酸化和寡聚化从而使得细胞膜完整性被破坏,细胞会破裂。
同时,RIPK1 会进入到细胞核中,促使一些炎症因子相关基因的表达,导致在细胞破裂后释放的内容物中含有炎症相关因子,引发炎症反应提示机体免疫系统。然而目前尚不清楚对于 RIPK1 进入到细胞核中是如何起到调节作用。此外,尽管已有许多文献报道在许多疾病如神经退行性疾病,多发性硬化症,急性心衰和早衰等中都涉及到了程序性坏死的发生,但对于 RIPK1 和程序性坏死在这些疾病如早衰过程中的作用和机制也尚不明朗。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心许代超课题组在 Nature cell biology 期刊上发表了题为 Defective prelamin A processing promotes unconventional necroptosis driven by nuclear RIPK1 的研究论文,发现 ZMPSTE24 基因缺陷会使得细胞对于肿瘤坏死因子刺激后由 RIPK1 介导的程序性坏死更为敏感,这个过程依赖于核纤层前体蛋白 A(Prelamin A)的累积。Prelamin A 在细胞核中为 RIPK1 的聚集和坏死体的形成提供了平台,促使 MLKL 的激活导致程序性坏死的发生。一旦从基因层面抑制了 RIPK1,RIPK3 或是 MLKL 的表达,能够有效缓解模型动物机体组织中细胞程序性坏死的发生并显著延长模型动物的生存期。

在高等真核细胞的细胞核内核膜和染色质间有一层厚度约为 30~100 毫微米的纤维蛋白片层,被称为核纤层(Lamina)。核纤层由包含核纤层蛋白 A(Lamin A)在内的多种核纤层蛋白构成,而 Lamin A 正是由核纤层前体蛋白 A(Prelamin A)在锌金属蛋白酶 ZMPSTE24 的剪切下形成。ZMPSTE24 基因突变会导致 Prelamin A剪切成为 Lamin A 的过程受阻,从而引发早衰类疾病,如 Hutchinson-Gilford 早衰症候群(Hutchinson-Gilford progeria syndrome,HGPS)。通常完全缺失 ZMPSTE24 的人类会在出生时便死亡,但完全缺失 ZMPSTE24 的小鼠却能正常出生,尽管很快就会表现出生长迟缓,毛发脱落,肌肉无力和自发性骨质疏松等一系列早衰症状。基因学研究已经发现这些症状是由法尼基化修饰的 Prelamin A 聚集,而不是 Lamin A 缺少引起的,但聚集后的 Prelamin A 具有如此毒性的分子机制还不清楚。
研究团队利用基于抗坏血酸过氧化物酶2(ascorbate peroxidase 2,APEX2)的标记技术结合质谱分析,发现能够与 Prelamin A 结合的多种蛋白中,RIPK1 具有最高的丰度。而通过构建 ZMPSTE24 缺乏的细胞系,研究团队发现 ZMPSTE24 缺乏后细胞系中的 RIPK1 表达量显著升高,这导致该细胞系对 TNF 的刺激更为敏感,更容易死亡。如果通过 RIPK1 的抑制剂 necrostatin-1s,或从基因层面沉默 RIPK1 的表达,能够保护细胞免受 TNF 的影响。
为了探究 ZMPSTE24 缺乏后引起的细胞敏感性是否和 Prelamin A 相关,研究团队利用特异性针对 Prelamin A 的反义寡核苷酸(ASO),ISIS-359445,对 ZMPSTE24 缺乏细胞系进行了处理,发现的确有效抑制了由 TNF 引起的死亡。进一步探究其具体机制,研究团队结合实验结果和文献调研,发现 Prelamin A 能够聚集形成一个平台用以募集更多的 RIPK1 聚集在一起,促进 RIPK1 的激活和坏死体的形成。并且这个过程的发生依赖于 RIPK1 在细胞核内的正确定位,以及 Prelamin A 的法尼基化修饰,一旦干扰了这两者,即使是 ZMPSTE24 缺陷的细胞系对于 TNF 的刺激也拥有了更高的耐受度。最终,聚集在一起的坏死体导致核膜破裂,细胞死亡。
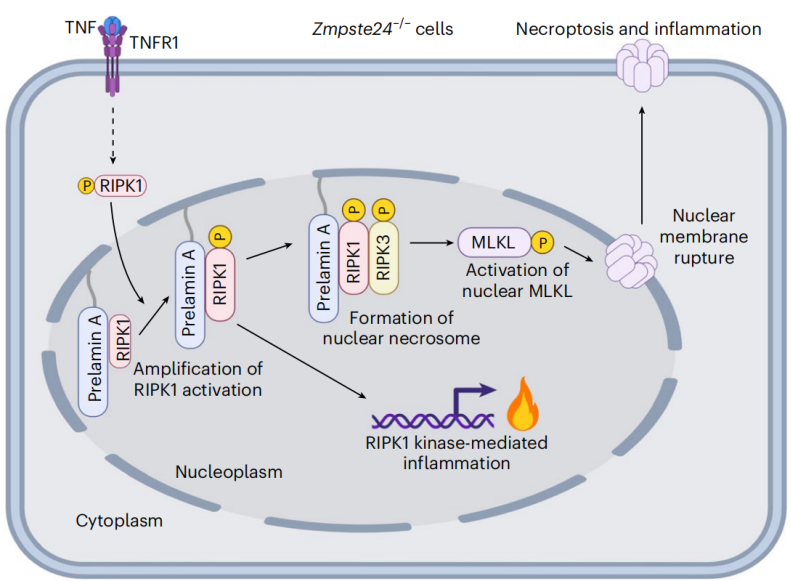
最后,研究团队也通过研究 ZMPSTE24 缺陷的小鼠发现当 ZMPSTE24 缺陷引发早衰后,其体内被磷酸化激活的 RIPK1,RIPK3 和 MLKL 均显著高于对照组,并且出现了大量细胞程序性坏死和严重的炎症反应。通过抑制这些渠道,能够显著延长早衰小鼠的生存期。这为早衰类疾病提供了一个潜在药物靶点。
由于 RIPK3 激酶抑制剂同时会诱导细胞发生凋亡,于是 RIPK1 抑制剂受到了各大药企的广泛关注。据报道 GSK 公司曾有过两个 RIPK1 抑制剂 GSK2982772 和 GSK095,分别针对外周自身免疫疾病和胰腺癌,然而后期临床实验被终止了,GSK 表示还需要更进一步研究。2022 年 5 月,赛诺菲和 Denail Therapeutics 合作开发的针对渐冻症的 RIPK1 抑制剂 SAR443820(DNL788,一款可渗透中枢神经系统的小分子药)获批临床,遗憾的是 2024 年 2 月发现该抑制剂在II期临床结果不理想。同时,赛诺菲和 Denail 还在开发 DNL788 用于治疗多发性硬化症,目前也处于II期临床阶段。2023 年 12 月,爱科诺生物的新型 RIPK1 抑制剂 AC-003 获得 FDA 孤儿药资格认定,该药物用于治疗急性移植物抗宿主病(aGvHD)。而本篇研究论文揭示了 RIPK1 在早衰症上的分子机制,这无疑为治疗早衰症这一罕见病提供了新的选择。
参考文献:
[1] Yang Y, Zhang J, Lv M, Cui N, Shan B, Sun Q, Yan L, Zhang M, Zou C, Yuan J, Xu D. Defective prelamin A processing promotes unconventional necroptosis driven by nuclear RIPK1. Nat Cell Biol. 2024 Apr;26(4):567-580. doi: 10.1038/s41556-024-01374-2. Epub 2024 Mar 27. PMID: 38538837.
【我们尊重原创,也注重分享。版权原作者所有,如有侵犯您的权益请及时联系,我们将第一时间删除。分享内容不代表本网观点,仅供参考。】

